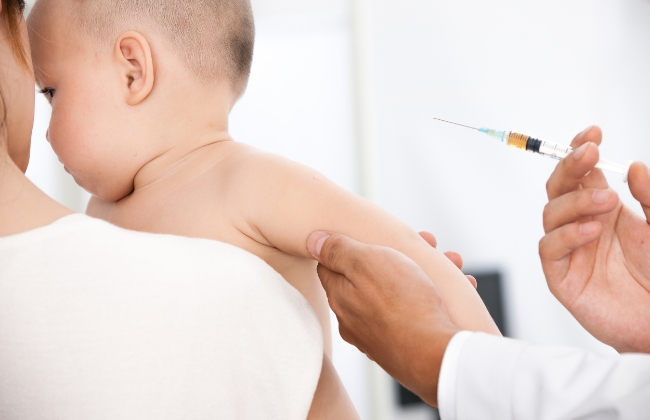
以创新的生物医药产品与服务让人类生活更美好

扫一扫关注 官方微信公众号

扫一扫关注 康华E讯

扫一扫关注 官方视频号

冻干人用狂犬病疫苗(人二倍体细胞)HDCV®
中国狂犬病疫苗迎来“人源”时代

起效速率快,14天平均抗体
水平高达阳转水平近40倍
免疫持续时间长达8年
不良反应率低于1%
安全性佳

使用健康人源细胞生产
创新工艺,高度纯化
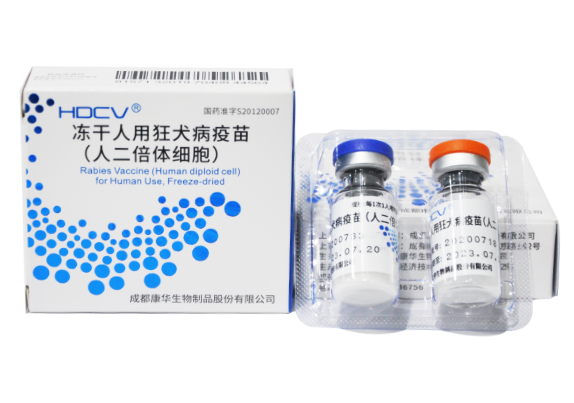
冻干人用狂犬病疫苗(人二倍体细胞)HDCV®
康华生物冻干人用狂犬病疫苗(人二倍体细胞)采用国内领先的“100L大体积生物反应器微载体规模化培养、扩增人二倍体细胞技术”,经层析纯化,为国内首个上市销售的人二倍体细胞狂犬病疫苗,打破了国内狂犬病疫苗一直沿用动物细胞制备的局限。
狂犬病是一种危害极大的病毒性人畜共患病,它是有史以来病死率最高的疾病(病死率为100%)。狂犬病的历史悠久,在古埃及、中国春秋时期的典籍中早已有对狂犬病的描述和记载。狂犬病在全世界绝大多数国家均有流行,世界卫生组织估计全球每年因狂犬病死亡约6万人,其中99%的病例发生在发展中国家,而亚洲是全球狂犬病流行最为严重的地区,约占全球发病总数的56%。
----- 数据来源《狂犬病预防控制技术指南(2016版)》HDC基质疫苗
使用健康人源细胞生产,安全性佳,无异源物质污染
药审中心《疫苗生产用细胞基质研究审评一般原则 》:
- 细胞基质作为生产疫苗的主要原材料,其质量的优劣,直接影响疫苗的质量和产量,尤其是疫苗的安全性。
- 人二倍体细胞在疫苗的生产过程中使用了30多年,证明是安全有效的,无致肿瘤性。
独家专利工艺
智造第二代“金标准”狂犬病疫苗(专利种类:发明专利 专利号ZL200910155068.6)

进口原材料,创新工艺,高度纯化
- 进口原材料
- 高度纯化HDCV®:◆第一代HDCV®基础上创新升级纯化。
- 高标准:◆质量均一稳定、质量标准高于国际标准。
- 生物反应器微载体培养:◆培养环境自动检测, 产品质量均一稳定。
- 纯化--分子筛柱层析:◆有效去除杂质,高度纯化。◆去除率高达99%。
免疫原性好
免疫性好,起效速度快,免疫持续时间长达8年

免疫性好,起效速度快
42天平均抗体水平( GMT )达到阳转水平75倍,14天抗体阳转率即达到100% 。 2008年,由江苏省疾病预防控制中心开展的康华HDCV® III期临床试验,共纳入1200例10-60岁高危狂犬病感染人群,随机分组,其中按暴露后流程接种HDCV® 60例。
免疫持续时间长达8年
接种8年后平均抗体水平(GMT)仍高达1.31 lU/ml。2016年,江苏省涟水县疾病预防控制中心在参加康华HDCV® 1期临床试验的志愿者中,随机抽取在此期间未接种狂犬病疫苗的志愿者60位进行8年免疫持久性研究。检测结果表明,全程接种康华HDCV® 8年之后,46.67%志愿者仍处于抗体阳转水平(>0.5IU/ml) ,GMT为1.31 IU/ml,加强接种一剂后,GMT迅速上升达30.61 IU /ml。
数据来源 - 《人二倍体细胞狂犬病疫苗免疫8 年后加强免疫效果研究 》安全性高
不良反应发生率低于1%,适用于全人群